技術・研究材料紹介(企業広告)
Corning® TransportoCellsTM HEK293由来ベシクル
コーニングインターナショナル(株)
ライフサイエンス事業部
和田格人
ABCトランスポーターはATPを駆動力として基質輸送を行う排泄型トランスポーターのグループに属します.この原理を利用して,本トランスポーター類を発現する細胞膜の反転膜小胞(inside-out vesicles)は基質取り込み輸送を測定する系として利用されます.すなわちABCトランスポーターを発現する細胞膜から反転膜小胞を調製すると,その基質輸送は小胞の外部から内部への取り込みとして測定できます.細胞において内側に存在するATP結合部位は反転膜小胞では外側に存在するので,反応系中のATPによりABCトランスポーターが駆動されます(図1).コーニングはこれまでバキュロウイルス/昆虫細胞発現系ABCトランスポーターベシクルを供給してきましたが,新たにHEK293細胞発現系同ベシクル類の取り扱いを開始しました.以下の記事で「ベシクル」は全て反転ベシクルを意味します.
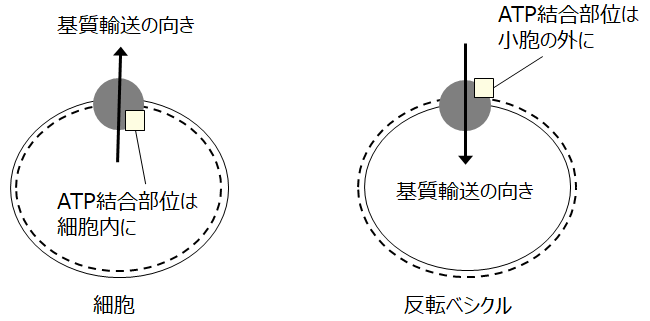
ABCトランスポーター発現ベシクルを用いる基質取り込み測定の方法
いずれもヒトのMDR1/P-gp,MRP2,BSEP,BCRPを発現させたベシクルをコーニングで製品化しました.アッセイはすでに販売している Corning GentestTM MRP/BCRP ベシクルアッセイキット(Cat. 459010)とBSEPベシクルアッセイキット(Cat. 459011)を使用し,96ウェル マイクロプレートを用いて rapid filtration法で測定しました.プレインキュベーション10分後,タンパク量50µg相当のベシクルを37℃でATPないしAMP共存下に各トランスポーターのプローブ基質と共に所定の時間インキュベートしたのち,冷やした洗浄バッファーを加えて反応を停止させ,96ウェル フィルタープレートでろ過し,フィルターに捕捉したベシクルの放射能量又は蛍光量を測定することで取込んだ基質量を測定しました(参考資料2).
ABCトランスポーター昆虫細胞発現系とHEK293発現系の差異
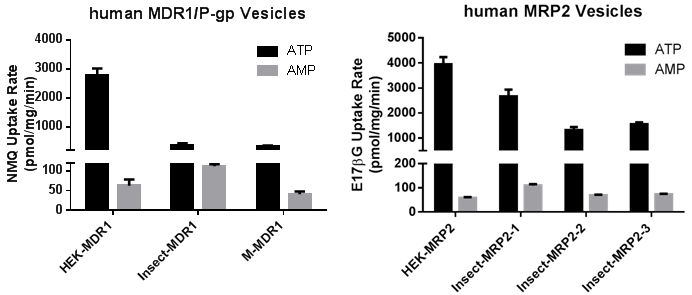
昆虫細胞発現系ベシクルは組換えバキュロウイルスが微量に残存している可能性があるため,カルタヘナ法の対象となります.一方,HEK293発現系は遺伝子ベクターにプラスミドを使用しており,組換えウイルス残存の可能性はないためカルタヘナ法の対象ではありません.さらにHEK293発現系には,後述のように昆虫細胞発現系に比べてより高い活性が得られるという性能上の利点があります.これは,ヒトタンパクをHEK293細胞(ヒト由来)で発現させたため,本来の翻訳後修飾状態に近いタンパクが産生されたことによると考えられます.
新たにベシクル化したABCトランスポーター4種類とその活性
最も重要なABCトランスポーターであるMDR1/P-gp発現ベシクルは昆虫細胞発現系では明瞭なS/N比を得られていませんでした.そこでHEK293発現系を用いたMDR1/P-gpベシクルの活性を調べました.表1にヒトMDR1ベシクルの基質取り込み活性とS/N比を示すとともに,それ以外の5種類のトランスポーター発現ベシクルの同データも示します.
| Transporter | Probe Substrate | Incubation Time (min) |
Uptake with ATP (pmol/min/mg protein) |
Uptake with AMP (pmol/min/mg protein) |
Signal to Noise Ratio (S/N) |
|---|---|---|---|---|---|
| Human MDR1/P-gp | 5μM NMQ | 2 | 2,762 | 62 | 45 |
| Human BSEP | 1μM TCA | 5 | 78 | 3.1 | 25 |
| Human MRP2 | 50μM E17βG | 5 | 3,848 | 58 | 68 |
| Human BCRP | 1μM E3S | 2 | 60.4 | 4.1 | 15 |
| Human MRP3 | 1µM E17βG | 5 | 49.3 | 4.4 | 11 |
| Human MRP4 | 2µM DHEAS | 5 | 49.3 | 4.3 | 12 |
NMQ(N-methyl-quinidine),TCA(taurocholate),E17βG(estradiol 17β-glucuronide),E3S(estrone-3-sulfate),DHEAS(Dehydroepiandrosterone 3-sulfate).NMQ取り込みは蛍光法で,それ以外の基質取り込みは放射性標識体を使用して測定した.
各トランスポーター発現ベシクル:昆虫系とHEK293系の違い
図2にヒト MDR1/P-gpとヒトMRP2発現ベシクルについて,昆虫細胞発現系とHEK293発現系の活性の比較を示します.いずれのトランスポーター発現ベシクルでもHEK293発現系の方が高活性であることが分かります.
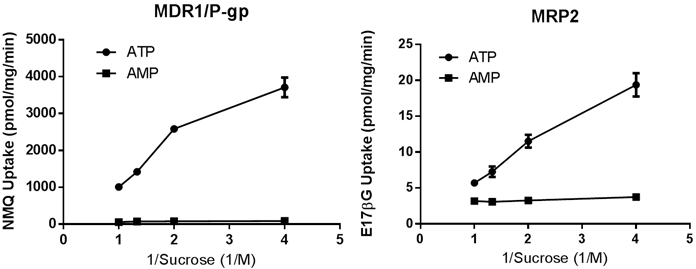
トランスポーター発現ベシクルによる基質取り込み活性のショ糖濃度依存性
図3のグラフはヒトのMDR1/P-gpとMRP2発現ベシクルによる標準基質の取り込み活性が,反応系ショ糖濃度の逆数に依存して上昇することを示します.ショ糖濃度が高いほどその逆数は低く,プロットはグラフの左側になります.このデータはABCトランスポーター発現ベシクルが閉じた袋として存在しており,浸透圧に応じて体積変化していることを示します.
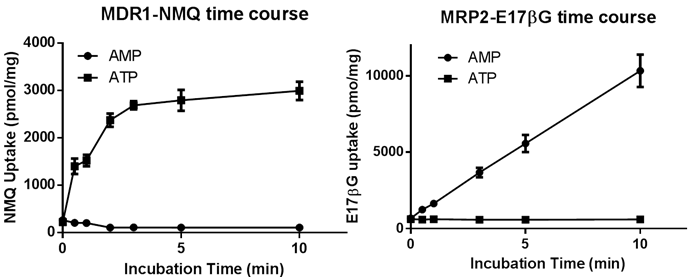
トランスポーター発現ベシクルによる基質取り込みの時間依存性
図4はヒトのMDR1/P-gpとMRP2ベシクルによる各標準基質取り込みの時間依存性を示します.MDR1によるNMQ取り込みは2分ほど直線的に進行し,それ以降頭打ちとなりました.一方MRP2によるE17βG取り込みは10分まで直線的に進行しました.
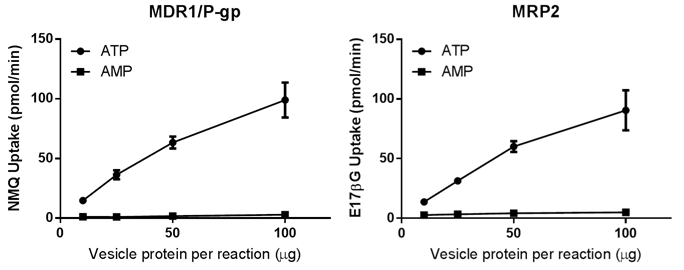
トランスポーター発現ベシクルによる基質取り込みのタンパク量依存性
図5はヒトのMDR1/P-gpとMRP2ベシクルによる標準基質取り込みのベシクルタンパク量依存性を示します.いずれのベシクルでも反応系内のタンパク量50μgまで直線で,それ以上になると直線の傾きが寝る傾向が見られました.このデータを元に標準プロトコールでは1測定のタンパク量を50μgに設定しています.
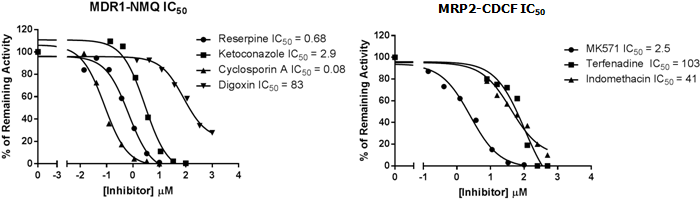
トランスポーター発現ベシクルによる基質取り込みの典型阻害剤による阻害の影響
図6はMDR1ベシクルによるNMQ取り込みに対する,4種類の典型的なMDR1阻害剤の阻害効果の濃度依存性です.いずれの阻害剤についても過去に文献等で報告されている値と同等のIC50値が得られました.本記事ではヒトMDR1(P-gp)に関するデータのみ示しましたが,ヒトのMRP2,BCRP,BSEPベシクルについても同様の検討を行っています(参考資料1).
結論
Corningが新たに製品化したHEK293発現ABCトランスポーターベシクルは,従来の昆虫細胞発現品に比べより高い活性とS/N比を示しました.これはトランスポータータンパクがより天然に近い翻訳後修飾と細胞膜環境にあるためと考えられます.さらに本トランスポーター類は,当該トランスポーターの典型阻害剤による阻害のIC50が文献値に近いことが示されました.本発現系ベシクル類は各トランスポーターの基質取り込み測定と薬物相互作用の検討に利用できる試薬であると思われます.
参考資料
- 2017 ISSX Poster: A New ABC Transporter Vesicle Model Using a Mammalian Expression System: Development and Characterization of Human P-gp/MDR1, MRP2, BSEP, and BCRP Transporter Vesicles. Jie Wang, Na Li, Kirsten Cooper, Joanne Bourgea, and Rongjun Zuo.
- Corning TransportoCellsTM HEK293-derived ABC-Transporter Vesicles. Instructions for Use. Corning Life Sciences 2017.




